3.3.1 การเกิดพันธะโคเวเลนต์
ธาตุอโลหะมีค่าอิเล็กโทรเนกาติวิตีสูง เมื่อรวมตัวกันจะไม่มีอะตอมใดยอมเสียอิเล็กตรอนจึงยึดเหนี่ยวกันโดยใช้เวเลนซ์อิเล็กตรอนร่วมกันเรียกการยึดเหนี่ยวนี้ว่า พันธะโคเวเลนต์ และเรียกสารที่อะตอมใช้ยึดเหนี่ยวกันว่า สารโคเวเลนต์
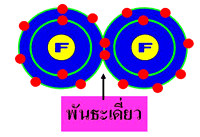
พันธะโคดเวเลนต์ที่เกิดจากการใช้อิเล็กตรอนร่วมกัน 1 คู่ เรียกว่า พันธะเดี่ยว โดยอิเล็กตรอนคู่ที่ใช้ร่วมกันในการเกิดพันธะเรียกว่า อิเล็กตรอนคู่ร่วมพันธะ ส่วนคู่ที่ไม่เกิดพันธะเรียกว่า อิเล็กตรอนคู่โดดเดี่ยว
อะตอมที่ใช้เวเลนซ์อิเล็กตรอนร่วมกัน 2 คู่ เรียกว่า พันธะคู่ และถ้าใช้เวเลนซ์อิเล็กตรอนร่วมกัน 3 คู่ก็จะเรียกว่า พันธะสาม
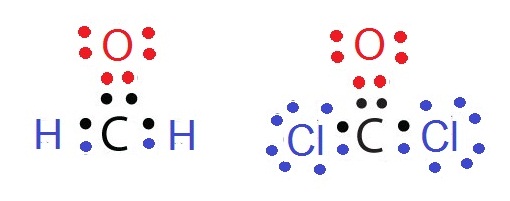
ตัวอย่างโครงสร้างลิวอิสของโมเลกุลโคเวเลนต์บางชนิด
3.3.2 สูตรโมเลกุลและชื่อของสารโคเวเลนต์
การเรียกชื่อสารโคดวดลนต์ มีหลักการดังนี้
- ถ้าประกอบด้วยธาตุชนิดเดียว เรียกชื่อตามธาตุนั้นโดยระบุสถานะด้วย ซึ่งส่วนใหญ่มีสถานะเป็นแก๊สที่อุณหภูมิห้อง
- ถ้าประกอบด้วยธาตุ 2 ชนิด เรียกตามลำดับที่ปรากฏในสูตรโมเลกุลโดยเปลี่ยนพยางค์หลังเป็นเสียง ไ-ด์ (-ide) และระบุจำนวนอะตอมธาตุองค์ประกอบในโมเลกุลด้วยคำในภาษากรีกตามตาราง
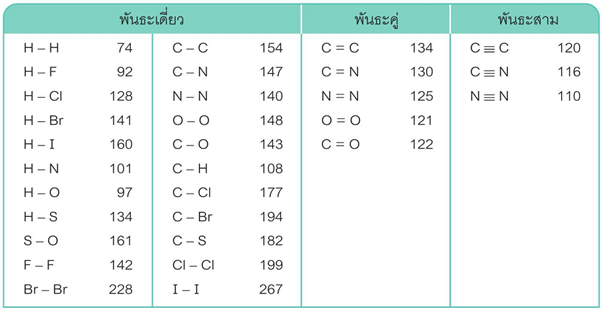
3.3.3 ความยาวพันธะและพลังงานพันธะของสารโคเวเลนต์
ตารางแสดงความยาวพันธะบางพันธะ
กราฟแสดงการเปลี่ยนแปลงพลังงานในการเกิดโมเลกุล
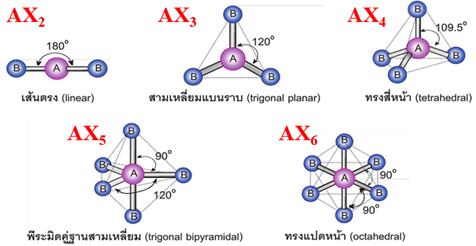
3.3.4 รูปร่างโมเลกุลโคเวเลนต์
มี 5 ลักษณะดังนี้
3.3.5 สภาพขั้วของโมเลกุลโคเวเลนต์
ถ้ามีการกระจายของกลุ่มหมอกอิเล็กตรอนคู่ร่วมพันธะระหว่างอตอมทั้งสองเท่ากัน เรียกว่า พันธะโคเวเลนต์ไม่มีขั้ว ส่วนสารโคดวดลนต์ที่เกิดจากอะตอมต่างชนิดกันและมีค่าอิเล็กโทรเนกาติวิตีต่างกันจะมีการกระจายตัวของกลุ่มหมอกอิเล็กตรอนคู่ร่วมพันธะระหว่างอะตอมไม่เท่ากัน เรียกว่า พันธะโคเวเลนต์มีขั้ว
δ+ แทนประจุไฟฟ้าค่อนข้างบวกในอะตอม δ- แทนประจุไฟฟ้าค่อนข้างลบในอะตอม
ขั้วของพันธะทำให้โมเลกุลอะตอมคู่ที่ประกอบด้วยธาตุชนิดเดียวกันเป็นโมเลกุลไม่มีขั้ว ส่วนถ้าประกอบด้วยธาตุต่างชนิดกันเป็นโมเลกุลมีขั้ว
ตัวอย่างแสดงรูปร่างโมเลกุลโคเวเลนต์ไม่มีขั้ว
3.3.6 แรงยึดเหนี่ยวระหว่างโมเลกุลและสมบัติของสารโคเวเลนต์
ที่อุณหภูมิห้อง สารโคเวเลนต์แต่ละชนิดอาจอยู่ในสถานะที่ แตกต่างกัน ขึ้นอยู่กับแรงยึดเหนี่ยวระหว่างโมเลกุลหรือแรงแวนเดอร์วาลส์
แรงยึดเหนี่ยวระหว่างโมเลกุลเกี่ยวข้องกับขนาดโมเลกุลและสภาพขั้วของโมเลกุล ซึ่งจะกล่าวถึง 3 ชนิด ได้แก่
- แรงแผ่กระจายลอนดอน เป็นแรงยึดเหนี่ยวระหว่างโมเลกุลไม่มีขั้วหรืออะตอมแก๊สโมเลกุลเป็นแรงอ่อนๆ โดยแรงจะเพิ่มขึ้นตามขนาดของโมเลกุล
- แรงระหว่างขั้ว เกิดจากสภาพขั้วโมเลกุลโดยโมเลกุลที่อยู่ใกล้กันจะหันส่วนของโมเลกุลที่มีขั้วตรงข้ามกันเข้าหากันเกิดเป็นแรงดึงดูดทางไฟฟ้าจากสภาพขั้ว โดยทั่วไปแรงนี้จะเพิ่มขึ้นตามสภาพขั้วของโมเลกุลที่มีขนาดใกล้เคียงกัน
- พันธะไฮโดรเจน
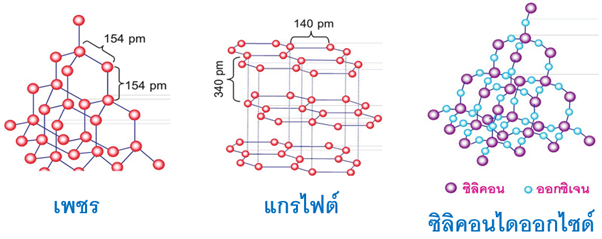
3.3.7 สารโคเวเลนต์โครงร่างตาข่าย
สารที่มีพันธะโคเวเลนต์เชื่อมต่อกันเป็นโครงร่างตาข่ายเรียกว่า สารโคเวเลนต์โครงร่างข่าย ทำให้สารบางชนิดเป็นอัญรูป
ตัวอย่างโครงสร้างผลึก






ความคิดเห็น
แสดงความคิดเห็น